Xem ngay lời giải chi tiết đề thi thử Hóa Học 2025 THPT trường Chuyên Vinh. Phân tích từng câu hỏi, mẹo giải nhanh, bám sát đề minh họa Bộ GD&ĐT!
Câu 1: Chất X có công thức cấu tạo (C$_{15}$H$_{31}$COO)$_{3}$C$_{3}$H$_{5}$. Tên gọi của X là :
A. tripalmitin.
B. tristearin.
C. trilinolein.
D. triolein.
Câu 2: 2-amino propanoic acid có kí hiệu :
A. Val.
B. Ala.
C. Gly.
D. Lys.
Câu 3: Nhóm khí nào sau đây trong không khí khi vượt quá mức cho phép sẽ gây ra hiện tượng mưa acid?
A. H$_{2}$, SO$_{2}$, N$_{2}$
B. SO$_{2}$, NO, NO$_{2}$.
C. CO, CH$_{4}$, N$_{2}$.
D. NH$_{3}$, H$_{2}$S, CO$_{2}$.
Câu 4: Đun nóng 6,0 gam acetic acid với 5,75 gam ethyl alcohol có H$_{2}$SO$_{4}$ đặc làm xúc tác. Khối lượng ester tạo thành khi hiệu suất phản ứng 80% là :
A. 7,04 gam.
B. 4,4 gam.
C. 8,8 gam.
D. 11,04 gam.
Câu 5: Hòa tan 23,4 gam hỗn hợp gồm Al, Fe, Cu bằng một lượng vừa đủ dung dịch H$_{2}$SO$_{4}$, thu được 0,675 mol khí SO$_{2}$ (sản phẩm khử duy nhất) và dung dịch chứa m gam muối. Giá trị của m là :
A. 88,2 gam.
B. 74,0 gam.
C. 131,2 gam.
D. 82,4 gam.
Câu 6: Nhận xét nào sau đây không đúng ?
A. Ag là kim loại dẫn điện tốt nhất.
B. Kim loại dẫn điện tốt thường dẫn nhiệt tốt.
C. Ở nhiệt độ thường, các kim loại đều ở trạng thái rắn.
D. Au, Ag, Al, Cu, Sn là những kim loại có tính dẻo cao.
Câu 7: Cho phổ khối lượng (MS) của một hợp chất hữu cơ X như sau :
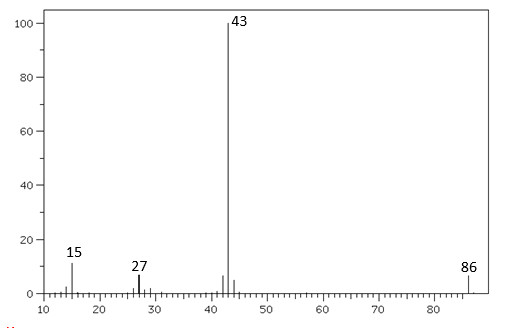
Chất X có thể là :
A. acetic acid.
B. isoamyl acetate.
C. methyl formate.
D. vinyl acetate.
Câu 8: Cho cân bằng hoá học sau: N$_{2}$(g) + 3H$_{2}$(g) ⇋ 2NH$_{3}$(g) Δ$_{r}$ $H_{298}^0$ = - 91,8 kJ. Nhận xét nào sau đây là đúng ?
A. Phản ứng trên là phản ứng thu nhiệt.
B. Khi tăng nhiệt độ thì tỉ khối của hỗn hợp so với H$_{2}$ sẽ tăng.
C. Khi phản ứng đạt đến trạng thái cân bằng, hỗn hợp có chứa N$_{2}$, H$_{2}$ và NH$_{3}$.
D. Cân bằng trên dịch chuyển theo chiều thuận khi giảm áp suất và giảm nhiệt độ.
Câu 9: Khi nấu canh cua thì thấy các mảng “riêu cua” nổi lên là do :
A. phản ứng thủy phân của protein.
B. phản ứng màu của protein.
C. sự đông tụ của protein do acid.
D. sự đông tụ của protein do nhiệt độ.
Câu 10: Hợp chất vô cơ X có một số ứng dụng như :
- Trong y học, X có thể được sử dụng để điều trị chứng dư acid ở dạ dày.
- Điều chỉnh vị chua của nước giải khát.
- Làm tăng độ xốp của bánh, làm mềm thực phẩm.
X là chất nào trong các chất sau ?
A. Na$_{2}$CO$_{3}$.
B. NaOH.
C. NaHCO$_{3}$.
D. NaCl.
Câu 11: Trong các loại tơ: len lông cừu, tơ tằm, tơ capron, tơ nitron, tơ visco có bao nhiêu tơ tổng hợp?
A. 4.
B. 1.
C. 5.
D. 2.
Câu 12: Liên kết được hình thành giữa các cation kim loại và các electron hóa trị tự do trong tinh thể kim loại là liên kết
A. cộng hóa trị.
B. kim loại.
C. ion.
D. hydrogen.
Câu 13: Cho các chất: Phenol, glucose, fructose, saccharose, maltose, aniline, methyl methacrylate. Có bao nhiêu chất có phản ứng với nước bromine?
A. 5.
B. 4.
C. 6.
D. 3.
Câu 14: Nguyên tố sodium có số hiệu nguyên tử là 11, nguyên tố chlorine có số hiệu nguyên tử là 17. Trong hợp chất sodium chloride có liên kết
A. hydrogen.
B. ion.
C. cộng hóa trị.
D. kim loại.
Câu 15: Acetic acid không phản ứng được với chất nào sau đây?
A. NH$_{3}$.
B. NaHCO$_{3}$.
C. Na$_{2}$SO$_{4}$.
D. Na
Câu 16: Để dập tắt các đám cháy do xăng dầu gây ra, người ta dùng cát hoặc bột chữa cháy MAP (NH$_{4}$H$_{2}$PO$_{4}$) mà không dùng nước. Cho các phát biểu sau:
(a) Xăng dầu nhẹ hơn nước và không tan trong nước nên nếu dùng nước xăng dầu sẽ nổi lên trên làm cho càng dễ cháy hơn.
(b) Cát hoặc bột chữa cháy MAP có tác dụng tạo lớp phủ bề mặt ngăn xăng dầu tiếp xúc với oxygen trong không khí.
(c) Quá trình nước bay hơi là quá trình tỏa nhiệt nên đám cháy xảy ra càng mạnh.
(d) Cát hoặc bột chữa cháy MAP hấp thụ nhiệt nên làm giảm nhiệt độ ngăn cản đám cháy.
Các phát biểu đúng là
A. (a), (b), (c).
B. (b), (c), (d).
C. (a), (c), (d).
D. (a), (b), (d).
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 - 18:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
Câu 17: Pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên có sức điện động chuẩn bằng 1,562V là
A. Zn - Ag.
B. Zn - Fe.
C. Al - Ag.
D. Fe - Cu.
Câu 18: Dựa vào giá trị thế điện cực chuẩn của các cặp oxi hóa – khử trên, có bao nhiêu kim loại có thể khử được Fe$^{3+}$ về Fe?
A. 2.
B. 4.
C. 3.
D. 1.
Câu 19: Nhúng thanh kẽm và thanh đồng (không tiếp xúc với nhau) vào cốc đựng dung dịch H$_{2}$SO$_{4}$ loãng. Nối thanh kẽm và thanh đồng bằng dây dẫn (có một khóa X) như hình bên.
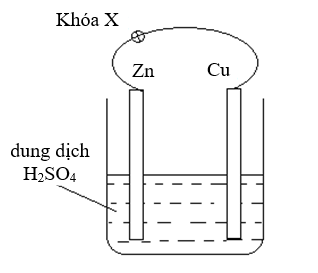
a) Khi chưa đóng khóa X xảy ra ăn mòn hóa học.
b) Khi đóng khóa X, xảy ra ăn mòn điện hóa và thanh Zn bị ăn mòn.
c) Tốc độ bọt khí thoát ra khi mở khóa X và khi đóng khóa X là như nhau.
d) Khi thay thanh Cu bằng thanh Mg, thanh Zn vẫn bị ăn mòn điện hóa.
Câu 20: Điện phân dung dịch MSO$_{4}$ (M là kim loại) với điện cực trơ, cường độ dòng điện không đổi. Sau thời gian t giây, thu được a mol khí ở anode. Nếu thời gian điện phân là 2t giây thì tổng số mol khí thu được ở cả hai điện cực là 2,5a mol. Giả sử hiệu suất điện phân là 100%, nước bay hơi không đáng kể, khí sinh ra không tan trong nước.
a) Tại thời điểm t giây, ion M$^{2+}$ chưa bị điện phân hết.
b) Trong quá trình điện phân pH của dung dịch giảm.
c) Tại thời điểm 2t giây, có bọt khí ở cathode.
d) Sau 1,75t giây, nếu tiếp tục điện phân thì có bọt khí ở cathode.
Câu 21: Vật liệu polymer đã và đang được sử dụng rộng rãi trong rất nhiều lĩnh vực. Với những ưu điểm vượt trội về tính chất, độ bền,… vật liệu polymer được ứng dụng rộng rãi trong đời sống như làm vật liệu cách điện và đặc biệt là vật liệu xây dựng mới như: sơn chống thấm, bê tông siêu nhẹ, gỗ công nghiệp, … Các polymer được điều chế bằng phản ứng trùng hợp hoặc trùng ngưng.
a) Trùng hợp buta-1,3-diene thu được polymer có cấu trúc tương tự cao su tự nhiên.
b) Sự khác biệt cơ bản giữa hai phản ứng điều chế polymer là: phản ứng trùng ngưng có tạo ra các phân tử nhỏ, còn trùng hợp thì không tạo ra các phân tử nhỏ.
c) Poly(vinyl acetate) được dùng để chế tạo sơn, keo dán. Để thu được 8,6 kg keo dán chứa 80% poly(vinyl acetate) cần 8,6 kg vinyl acetate biết hiệu suất quá trình trùng hợp là 80%.
d) Nylon-6,6 được sử dụng phổ biến trong ngành dệt may và được điều chế từ phản ứng trùng ngưng.
Câu 22: Triglyceride đóng vai trò là nguồn cung cấp năng lượng và chuyên chở các chất béo trong quá trình trao đổi chất. Cho triglyceride X có công thức cấu tạo như hình sau:
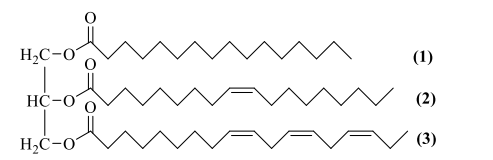
a) Công thức phân tử của X là C$_{55}$H$_{98}$O$_{6}$.
b) Acid béo có gốc kí hiệu (2) thuộc loại acid béo omega-9.
c) Các gốc của acid béo không no trong phân tử X đều có cấu hình cis-.
d) Hydrogen hoá hoàn toàn 427 kg X bằng hydrogen (dư) ở nhiệt độ cao và áp suất cao, Ni xúc tác được 432 kg chất béo rắn.
Câu 23: Ion Ca$^{2+}$ cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC$_{2}$O$_{4}$) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau:
KMnO$_{4}$ + CaC$_{2}$O$_{4}$ + H$_{2}$SO$_{4}$ → CaSO$_{4}$ + K$_{2}$SO$_{4}$ + MnSO$_{4}$ + CO$_{2}$ + H$_{2}$O
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2 mL dung dịch potassium permanganate (KMnO$_{4}$) 5.10$^{-4}$M. Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca$^{2+}$/100 mL máu.
Câu 24: Kết quả phân tích nguyên tố của một α-amino acid X như sau: %C = 46,60%; %H = 8,74%; %N = 13,59% (về khối lượng); còn lại là oxygen. Bằng phổ khối lượng (MS), xác định được phân tử khối của X bằng 103. Số công thức cấu tạo thỏa mãn của X là bao nhiêu?
Câu 25: Cho các chất: Methylamine, propane-1-ol, methyl formate, acetic acid và các giá trị nhiệt độ sôi (không theo thứ tự) là 118,0°C; 97,0°C, -6,4°C; 32,0°C. Nhiệt độ sôi của methyl formate có giá trị là bao nhiêu °C?.
Câu 26: Cho 7,3 gam amine bậc hai đơn chức X tác dụng với dung dịch HCl vừa đủ thu được 10,95 gam muối. X có bao nhiêu công thức cấu tạo phù hợp?
Câu 27: Saccharose có công thức phân tử C$_{12}$H$_{22}$O$_{11}$, cấu tạo từ một đơn vị α-glucose và một đơn vị β-fructose qua liên kết α-1,2-glycoside. Trong phân tử saccharose có bao nhiêu nhóm –OH?
Câu 28: Nung nóng 11,9 gam hỗn hợp Mg, Al, Fe trong không khí một thời gian, thu được 13,5 gam hỗn hợp rắn X. Hòa tan hoàn toàn X bằng V mL dung dịch HCl 1M, thu được 7,437 lít khí H$_{2}$ (ở đkc) và dung dịch chỉ chứa muối. Giá trị của V là bao nhiêu?
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn.
Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.Câu 1: Chất X có công thức cấu tạo (C$_{15}$H$_{31}$COO)$_{3}$C$_{3}$H$_{5}$. Tên gọi của X là :
A. tripalmitin.
B. tristearin.
C. trilinolein.
D. triolein.
Tên gọi của (C$_{15}$H$_{31}$COO)$_{3}$C$_{3}$H$_{5}$ là tripalmitin.
A. Val.
B. Ala.
C. Gly.
D. Lys.
2-amino propanoic acid (CH$_{3}$-CH(NH$_{2}$)-COOH) có kí hiệu là Ala.
A. H$_{2}$, SO$_{2}$, N$_{2}$
B. SO$_{2}$, NO, NO$_{2}$.
C. CO, CH$_{4}$, N$_{2}$.
D. NH$_{3}$, H$_{2}$S, CO$_{2}$.
Nhóm khí SO$_{2}$, NO, NO$_{2}$ trong không khí khi vượt quá mức cho phép sẽ gây ra hiện tượng mưa acid do các oxide này chuyển hóa thành acid mạnh H$_{2}$SO$_{4}$, HNO$_{3}$ theo nước mưa rơi xuống.
A. 7,04 gam.
B. 4,4 gam.
C. 8,8 gam.
D. 11,04 gam.
CH$_{3}$COOH + C$_{2}$H$_{5}$OH ⇋ CH$_{3}$COOC$_{2}$H$_{5}$ + H$_{2}$O
nCH$_{3}$COOH = 0,1; nC$_{2}$H$_{5}$OH = 0,125
H = 80% → nCH$_{3}$COOC$_{2}$H$_{5}$ = 0,1.80% = 0,08
→ mCH$_{3}$COOC$_{2}$H$_{5}$ = 0,08.88 = 7,04 gam
nCH$_{3}$COOH = 0,1; nC$_{2}$H$_{5}$OH = 0,125
H = 80% → nCH$_{3}$COOC$_{2}$H$_{5}$ = 0,1.80% = 0,08
→ mCH$_{3}$COOC$_{2}$H$_{5}$ = 0,08.88 = 7,04 gam
A. 88,2 gam.
B. 74,0 gam.
C. 131,2 gam.
D. 82,4 gam.
nSO$_{4}$$^{2-}$(muối) = ne/2 = nSO$_{2}$ = 0,675
→ m muối = m kim loại + mSO$_{4}$$^{2-}$(muối) = 88,2 gam
→ m muối = m kim loại + mSO$_{4}$$^{2-}$(muối) = 88,2 gam
A. Ag là kim loại dẫn điện tốt nhất.
B. Kim loại dẫn điện tốt thường dẫn nhiệt tốt.
C. Ở nhiệt độ thường, các kim loại đều ở trạng thái rắn.
D. Au, Ag, Al, Cu, Sn là những kim loại có tính dẻo cao.
A. Đúng
B. Đúng, vì tính dẫn điện hay dẫn nhiệt đều do electron tự do gây ra.
C. Sai, ở nhiệt độ thường Hg ở trạng thái lỏng, các kim loại khác đều ở trạng thái rắn.
D. Đúng
B. Đúng, vì tính dẫn điện hay dẫn nhiệt đều do electron tự do gây ra.
C. Sai, ở nhiệt độ thường Hg ở trạng thái lỏng, các kim loại khác đều ở trạng thái rắn.
D. Đúng

Chất X có thể là :
A. acetic acid.
B. isoamyl acetate.
C. methyl formate.
D. vinyl acetate.
M$_{X}$ = 86 → Chọn X là vinyl acetate (CH$_{3}$COOCH=CH$_{2}$).
A. Phản ứng trên là phản ứng thu nhiệt.
B. Khi tăng nhiệt độ thì tỉ khối của hỗn hợp so với H$_{2}$ sẽ tăng.
C. Khi phản ứng đạt đến trạng thái cân bằng, hỗn hợp có chứa N$_{2}$, H$_{2}$ và NH$_{3}$.
D. Cân bằng trên dịch chuyển theo chiều thuận khi giảm áp suất và giảm nhiệt độ.
A. Sai, chiều thuận là phản ứng tỏa nhiệt, chiều nghịch là phản ứng thu nhiệt.
B. Sai, khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch → Số mol khí tăng → M khí giảm → Tỉ khối của hỗn hợp so với H$_{2}$ sẽ giảm.
C. Đúng
D. Sai, giảm áp suất làm cân bằng chuyển dịch theo chiều nghịch (tăng số phân tử khí). Giảm nhiệt độ làm cân bằng chuyển dịch theo chiều thuận.
B. Sai, khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch → Số mol khí tăng → M khí giảm → Tỉ khối của hỗn hợp so với H$_{2}$ sẽ giảm.
C. Đúng
D. Sai, giảm áp suất làm cân bằng chuyển dịch theo chiều nghịch (tăng số phân tử khí). Giảm nhiệt độ làm cân bằng chuyển dịch theo chiều thuận.
A. phản ứng thủy phân của protein.
B. phản ứng màu của protein.
C. sự đông tụ của protein do acid.
D. sự đông tụ của protein do nhiệt độ.
Khi nấu canh cua thì thấy các mảng “riêu cua” nổi lên là do sự đông tụ của protein do nhiệt độ.
Nước lọc từ cua xay nát chứa nhiều protein hòa tan, các protein này sẽ đông tụ lại khi đun nóng.
Nước lọc từ cua xay nát chứa nhiều protein hòa tan, các protein này sẽ đông tụ lại khi đun nóng.
- Trong y học, X có thể được sử dụng để điều trị chứng dư acid ở dạ dày.
- Điều chỉnh vị chua của nước giải khát.
- Làm tăng độ xốp của bánh, làm mềm thực phẩm.
X là chất nào trong các chất sau ?
A. Na$_{2}$CO$_{3}$.
B. NaOH.
C. NaHCO$_{3}$.
D. NaCl.
Chất X là NaHCO$_{3}$. Chất này được sử dụng để điều trị chứng dư acid ở dạ dày và điều chỉnh vị chua của nước giải khát do phản ứng:
NaHCO$_{3}$ + H$^{+}$ → Na$^{+}$ + CO$_{2}$ + H$_{2}$O
X làm tăng độ xốp của bánh, làm mềm thực phẩm do tạo nhiều khí và hơi khi bị nhiệt phân:
NaHCO$_{3}$ → Na$_{2}$CO$_{3}$ + CO$_{2}$ + H$_{2}$O
NaHCO$_{3}$ + H$^{+}$ → Na$^{+}$ + CO$_{2}$ + H$_{2}$O
X làm tăng độ xốp của bánh, làm mềm thực phẩm do tạo nhiều khí và hơi khi bị nhiệt phân:
NaHCO$_{3}$ → Na$_{2}$CO$_{3}$ + CO$_{2}$ + H$_{2}$O
A. 4.
B. 1.
C. 5.
D. 2.
Có 2 tơ tổng hợp trong dãy là tơ capron, tơ nitron.
Len lông cừu, tơ tằm là tơ thiên nhiên, tơ visco là tơ bán tổng hợp.
Len lông cừu, tơ tằm là tơ thiên nhiên, tơ visco là tơ bán tổng hợp.
A. cộng hóa trị.
B. kim loại.
C. ion.
D. hydrogen.
Liên kết được hình thành giữa các cation kim loại và các electron hóa trị tự do trong tinh thể kim loại là liên kết kim loại.
A. 5.
B. 4.
C. 6.
D. 3.
Có 5 chất có phản ứng với nước bromine, gồm: Phenol, glucose, maltose, aniline, methyl methacrylate.
A. hydrogen.
B. ion.
C. cộng hóa trị.
D. kim loại.
Na (Z = 11) là kim loại điển hình, Cl (Z = 17) là phi kim điển hình → Trong hợp chất NaCl có liên kết ion
A. NH$_{3}$.
B. NaHCO$_{3}$.
C. Na$_{2}$SO$_{4}$.
D. Na
A. CH$_{3}$COOH + NH$_{3}$ → CH$_{3}$COONH$_{4}$
B. CH$_{3}$COOH + NaHCO$_{3}$ → CH$_{3}$COONa + CO$_{2}$ + H$_{2}$O
C. Không phản ứng.
D. CH$_{3}$COOH + Na → CH$_{3}$COONa + ½H$_{2}$
B. CH$_{3}$COOH + NaHCO$_{3}$ → CH$_{3}$COONa + CO$_{2}$ + H$_{2}$O
C. Không phản ứng.
D. CH$_{3}$COOH + Na → CH$_{3}$COONa + ½H$_{2}$
(a) Xăng dầu nhẹ hơn nước và không tan trong nước nên nếu dùng nước xăng dầu sẽ nổi lên trên làm cho càng dễ cháy hơn.
(b) Cát hoặc bột chữa cháy MAP có tác dụng tạo lớp phủ bề mặt ngăn xăng dầu tiếp xúc với oxygen trong không khí.
(c) Quá trình nước bay hơi là quá trình tỏa nhiệt nên đám cháy xảy ra càng mạnh.
(d) Cát hoặc bột chữa cháy MAP hấp thụ nhiệt nên làm giảm nhiệt độ ngăn cản đám cháy.
Các phát biểu đúng là
A. (a), (b), (c).
B. (b), (c), (d).
C. (a), (c), (d).
D. (a), (b), (d).
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 - 18:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
| Cặp | Al$^{3+}$/Al | Zn$^{2+}$/Zn | Fe$^{2+}$/Fe | Cu$^{2+}$/Cu | Fe$^{3+}$/Fe$^{2+}$ | Ag$^{+}$/Ag | Au$^{3+}$/Au |
| E°(V) | -1,676 | -0,763 | -0,440 | 0,340 | 0,771 | 0,799 | 1,520 |
(a)(b) Đúng
(c) Sai, quá trình bay hơi nước thu nhiệt nhưng nước chìm xuống dưới nên quá trình bay hơi xảy ra không đáng kể (do đối lưu nên nhiệt sẽ thoát lên trên).
(d) Đúng, cát hoặc bột chữa cháy MAP làm giảm nhiệt độ đám cháy và ngăn xăng tiếp cận O$_{2}$.
(c) Sai, quá trình bay hơi nước thu nhiệt nhưng nước chìm xuống dưới nên quá trình bay hơi xảy ra không đáng kể (do đối lưu nên nhiệt sẽ thoát lên trên).
(d) Đúng, cát hoặc bột chữa cháy MAP làm giảm nhiệt độ đám cháy và ngăn xăng tiếp cận O$_{2}$.
A. Zn - Ag.
B. Zn - Fe.
C. Al - Ag.
D. Fe - Cu.
A. E°Zn-Ag = 1,562V
B. E°Zn-Fe = 0,323V
C. E°Al-Ag = 2,475V
D. E°Fe-Cu = 0,78V
B. E°Zn-Fe = 0,323V
C. E°Al-Ag = 2,475V
D. E°Fe-Cu = 0,78V
A. 2.
B. 4.
C. 3.
D. 1.
Quá trình khử Fe$^{3+}$ → Fe$^{2+}$ → Fe nên có 2 kim loại khử được Fe$^{3+}$ về Fe là Al, Zn.
PHẦN II. Câu trắc nghiệm đúng sai.
Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.Câu 19: Nhúng thanh kẽm và thanh đồng (không tiếp xúc với nhau) vào cốc đựng dung dịch H$_{2}$SO$_{4}$ loãng. Nối thanh kẽm và thanh đồng bằng dây dẫn (có một khóa X) như hình bên.

a) Khi chưa đóng khóa X xảy ra ăn mòn hóa học.
b) Khi đóng khóa X, xảy ra ăn mòn điện hóa và thanh Zn bị ăn mòn.
c) Tốc độ bọt khí thoát ra khi mở khóa X và khi đóng khóa X là như nhau.
d) Khi thay thanh Cu bằng thanh Mg, thanh Zn vẫn bị ăn mòn điện hóa.
(a) Đúng, khi khóa X mở, thanh Zn bị ăn mòn hóa học:
Zn + H$_{2}$SO$_{4}$ → ZnSO$_{4}$ + H$_{2}$
(b) Đúng, khi đóng khóa X thì mạch điện kín và có ăn mòn điện hóa, trong đó Zn là anode và bị ăn mòn, Cu là cathode.
(c) Sai, ăn mòn điện hóa diễn ra với tốc độ nhanh hơn ăn mòn hóa học nên khi khóa X đóng thì H$_{2}$ thoát ra nhanh hơn và chủ yếu bên thanh Cu. Khi khóa X mở thì H$_{2}$ thoát ra chậm hơn và chỉ có bên thanh Zn.
(d) Sai, thay Cu bằng Mg thì thanh Mg là anode và bị ăn mòn điện hóa, thanh Zn là cathode, không bị ăn mòn điện hóa.
Zn + H$_{2}$SO$_{4}$ → ZnSO$_{4}$ + H$_{2}$
(b) Đúng, khi đóng khóa X thì mạch điện kín và có ăn mòn điện hóa, trong đó Zn là anode và bị ăn mòn, Cu là cathode.
(c) Sai, ăn mòn điện hóa diễn ra với tốc độ nhanh hơn ăn mòn hóa học nên khi khóa X đóng thì H$_{2}$ thoát ra nhanh hơn và chủ yếu bên thanh Cu. Khi khóa X mở thì H$_{2}$ thoát ra chậm hơn và chỉ có bên thanh Zn.
(d) Sai, thay Cu bằng Mg thì thanh Mg là anode và bị ăn mòn điện hóa, thanh Zn là cathode, không bị ăn mòn điện hóa.
a) Tại thời điểm t giây, ion M$^{2+}$ chưa bị điện phân hết.
b) Trong quá trình điện phân pH của dung dịch giảm.
c) Tại thời điểm 2t giây, có bọt khí ở cathode.
d) Sau 1,75t giây, nếu tiếp tục điện phân thì có bọt khí ở cathode.
Tại anode:
Sau t giây → nO$_{2}$ = a
Sau 2t giây → nO$_{2}$ = 2a
→ Lúc 2t giây tại cathode: nH$_{2}$ = 2,5a – 2a = 0,5a
Bảo toàn electron: 2nM + 2nH$_{2}$ = 4nO$_{2}$
→ nM = 4a – 0,5a = 3,5a
(a) Đúng, lúc t giây có ne = 4a → nM$^{2+}$ bị điện phân = 2a < nM$^{2+}$ ban đầu nên M$^{2+}$ chưa hết.
(b) Đúng:
+ Trong quá trình điện phân MSO$_{4}$, pH của dung dịch giảm do tạo thành H$_{2}$SO$_{4}$:
CuSO$_{4}$ + H$_{2}$O → Cu + O$_{2}$ + H$_{2}$SO$_{4}$
+ Khi H$_{2}$O bị điện phân ở cả 2 điện cực pH vẫn giảm do thể tích dung dịch giảm dần.
(c) Đúng, lúc 2t giây cathode có 0,5a mol H$_{2}$
(d) Đúng, M$^{2+}$ bị khử hết khi ne = 2nM = 7a. Tại thời điểm 1,75t có ne = 1,75.4a = 7a → Vừa hết M$^{2+}$ → Nếu tiếp tục điện phân thì có bọt khí ở cathode.
Sau t giây → nO$_{2}$ = a
Sau 2t giây → nO$_{2}$ = 2a
→ Lúc 2t giây tại cathode: nH$_{2}$ = 2,5a – 2a = 0,5a
Bảo toàn electron: 2nM + 2nH$_{2}$ = 4nO$_{2}$
→ nM = 4a – 0,5a = 3,5a
(a) Đúng, lúc t giây có ne = 4a → nM$^{2+}$ bị điện phân = 2a < nM$^{2+}$ ban đầu nên M$^{2+}$ chưa hết.
(b) Đúng:
+ Trong quá trình điện phân MSO$_{4}$, pH của dung dịch giảm do tạo thành H$_{2}$SO$_{4}$:
CuSO$_{4}$ + H$_{2}$O → Cu + O$_{2}$ + H$_{2}$SO$_{4}$
+ Khi H$_{2}$O bị điện phân ở cả 2 điện cực pH vẫn giảm do thể tích dung dịch giảm dần.
(c) Đúng, lúc 2t giây cathode có 0,5a mol H$_{2}$
(d) Đúng, M$^{2+}$ bị khử hết khi ne = 2nM = 7a. Tại thời điểm 1,75t có ne = 1,75.4a = 7a → Vừa hết M$^{2+}$ → Nếu tiếp tục điện phân thì có bọt khí ở cathode.
a) Trùng hợp buta-1,3-diene thu được polymer có cấu trúc tương tự cao su tự nhiên.
b) Sự khác biệt cơ bản giữa hai phản ứng điều chế polymer là: phản ứng trùng ngưng có tạo ra các phân tử nhỏ, còn trùng hợp thì không tạo ra các phân tử nhỏ.
c) Poly(vinyl acetate) được dùng để chế tạo sơn, keo dán. Để thu được 8,6 kg keo dán chứa 80% poly(vinyl acetate) cần 8,6 kg vinyl acetate biết hiệu suất quá trình trùng hợp là 80%.
d) Nylon-6,6 được sử dụng phổ biến trong ngành dệt may và được điều chế từ phản ứng trùng ngưng.
(a) Sai, cao su tự nhiên là polymer của isoprene với kiểu 1,4 và 100% cấu hình cis. Trùng hợp buta$^{-1}$,$^{3-}$diene thu được cao su có cấu hình cả cis và trans (kiểu 1,4), ngoài ra còn có nhánh vinyl do trùng hợp kiểu 1,2.
(b) Đúng
(c) Đúng, m keo dán = 8,6.80%/80% = 8,6 kg.
(d) Đúng
(b) Đúng
(c) Đúng, m keo dán = 8,6.80%/80% = 8,6 kg.
(d) Đúng

a) Công thức phân tử của X là C$_{55}$H$_{98}$O$_{6}$.
b) Acid béo có gốc kí hiệu (2) thuộc loại acid béo omega-9.
c) Các gốc của acid béo không no trong phân tử X đều có cấu hình cis-.
d) Hydrogen hoá hoàn toàn 427 kg X bằng hydrogen (dư) ở nhiệt độ cao và áp suất cao, Ni xúc tác được 432 kg chất béo rắn.
(a) Đúng, X là (C$_{15}$H$_{31}$COO)(C$_{17}$H$_{33}$COO)(C$_{17}$H$_{29}$COO)C$_{3}$H$_{5}$ (C$_{55}$H$_{98}$O$_{6}$).
(b) Đúng, nối đôi C=C cuối cùng của (2) ở C số 9 nên gốc kí hiệu (2) thuộc loại acid béo omega (18 – 9 = 9)
(c) Đúng
(d) Sai: C$_{55}$H$_{98}$O$_{6}$ + 4H$_{2}$ → C$_{55}$H$_{106}$O$_{6}$
→ mC$_{55}$H$_{106}$O$_{6}$ = 427.862/854 = 431 kg
(b) Đúng, nối đôi C=C cuối cùng của (2) ở C số 9 nên gốc kí hiệu (2) thuộc loại acid béo omega (18 – 9 = 9)
(c) Đúng
(d) Sai: C$_{55}$H$_{98}$O$_{6}$ + 4H$_{2}$ → C$_{55}$H$_{106}$O$_{6}$
→ mC$_{55}$H$_{106}$O$_{6}$ = 427.862/854 = 431 kg
PHẦN III. Câu trắc nghiệm trả lời ngắn.
Thí sinh trả lời từ câu 23 đến câu 28.Câu 23: Ion Ca$^{2+}$ cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC$_{2}$O$_{4}$) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau:
KMnO$_{4}$ + CaC$_{2}$O$_{4}$ + H$_{2}$SO$_{4}$ → CaSO$_{4}$ + K$_{2}$SO$_{4}$ + MnSO$_{4}$ + CO$_{2}$ + H$_{2}$O
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2 mL dung dịch potassium permanganate (KMnO$_{4}$) 5.10$^{-4}$M. Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca$^{2+}$/100 mL máu.
5CaC$_{2}$O$_{4}$ + 2KMnO$_{4}$ + 8H$_{2}$SO$_{4}$ → 5CaSO$_{4}$ + K$_{2}$SO$_{4}$ + 2MnSO$_{4}$ + 10CO$_{2}$↑ + 8H$_{2}$O
Trong 1 ml máu:
nKMnO$_{4}$ = 0,002.5.10$^{-4}$ = 1.10$^{-6}$
→ nCa$^{2+}$ = nCaC$_{2}$O$_{4}$ = 2,5.10$^{-6}$
Trong 100 ml máu: nCa$^{2+}$ = 2,5.10$^{-4}$
→ mCa$^{2+}$ = 2,5.10$^{-4}$.40 = 0,01 gam = 10 mg
→ Nồng độ Ca$^{2+}$ = 10 mg/100 ml
Trong 1 ml máu:
nKMnO$_{4}$ = 0,002.5.10$^{-4}$ = 1.10$^{-6}$
→ nCa$^{2+}$ = nCaC$_{2}$O$_{4}$ = 2,5.10$^{-6}$
Trong 100 ml máu: nCa$^{2+}$ = 2,5.10$^{-4}$
→ mCa$^{2+}$ = 2,5.10$^{-4}$.40 = 0,01 gam = 10 mg
→ Nồng độ Ca$^{2+}$ = 10 mg/100 ml
Số C = 103.46,60%/12 = 4
Số H = 103.8,74%/1 = 9
Số N = 103.13,59%/12 = 1
Số O = (103 – 12.4 – 1.9 – 14.1)/16 = 2
X là C$_{4}$H$_{9}$NO$_{2}$, X có 2 đồng phân α-amino acid:
CH$_{3}$-CH$_{2}$-CH(NH$_{2}$)-COOH
(CH$_{3}$)$_{2}$C(NH$_{2}$)-COOH
Số H = 103.8,74%/1 = 9
Số N = 103.13,59%/12 = 1
Số O = (103 – 12.4 – 1.9 – 14.1)/16 = 2
X là C$_{4}$H$_{9}$NO$_{2}$, X có 2 đồng phân α-amino acid:
CH$_{3}$-CH$_{2}$-CH(NH$_{2}$)-COOH
(CH$_{3}$)$_{2}$C(NH$_{2}$)-COOH
CH$_{3}$NH$_{2}$ là chất khí điều kiện thường, các chất còn lại là chất lỏng → CH$_{3}$NH$_{2}$ < 25°C < Các chất còn lại.
→ Nhiệt độ sôi CH$_{3}$COOH > CH$_{3}$CH$_{2}$CH$_{2}$OH > HCOOCH$_{3}$ > CH$_{3}$NH$_{2}$
→ HCOOCH$_{3}$ có nhiệt độ sôi là 32,0°C.
→ Nhiệt độ sôi CH$_{3}$COOH > CH$_{3}$CH$_{2}$CH$_{2}$OH > HCOOCH$_{3}$ > CH$_{3}$NH$_{2}$
→ HCOOCH$_{3}$ có nhiệt độ sôi là 32,0°C.
X đơn chức nên nX = nHCl = (m muối – mX)/36,5 = 0,1
→ M$_{X}$ = 7,3/0,1 = 73: C$_{4}$H$_{11}$N
X có 3 đồng phân amine bậc 2:
CH$_{3}$-NH-CH$_{2}$-CH$_{2}$-CH$_{3}$
CH$_{3}$-NH-CH(CH$_{3}$)$_{2}$
CH$_{3}$-CH$_{2}$-NH-CH$_{2}$-CH$_{3}$
→ M$_{X}$ = 7,3/0,1 = 73: C$_{4}$H$_{11}$N
X có 3 đồng phân amine bậc 2:
CH$_{3}$-NH-CH$_{2}$-CH$_{2}$-CH$_{3}$
CH$_{3}$-NH-CH(CH$_{3}$)$_{2}$
CH$_{3}$-CH$_{2}$-NH-CH$_{2}$-CH$_{3}$
Trong 11 oxygen, có 3 nguyên tử oxygen đang hiện diện ở nhóm chức ether, số còn lại ở nhóm chức -OH → Saccharose có 8 nhóm -OH.
nH$_{2}$O = nO(X) = (mX – m kim loại)/16 = 0,1
nH$_{2}$ = 0,3
Bảo toàn H: nHCl = 2nH$_{2}$O + 2nH$_{2}$ = 0,8
→ V = 800 mL
nH$_{2}$ = 0,3
Bảo toàn H: nHCl = 2nH$_{2}$O + 2nH$_{2}$ = 0,8
→ V = 800 mL
